Teori kinetik gas - Image from ilmuhitung.com
Pada kesempatan kali ini kami akan membahas materi tentang teori kinetik gas. Dalam materi ini kita akan mencoba untuk membahas secara keseluruhan, mulai dari pengertian, asumsi, hukum hingga pembahasan yang dibedakan dengan teori kinetik gas makroskopis dan teori kinetik gas mikroskopis.
Berikut penjelasan tentang teori kinetik gas.
Pengertian Teori Kinetik Gas
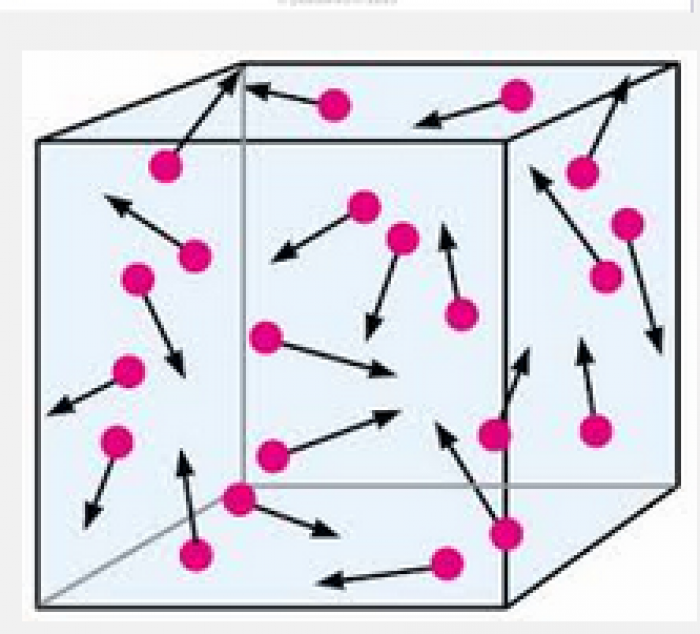
Teori kinetik mengatakan bahwa setiap zat terdiri dari atom atau molekul dan atom atau molekul tersebut bergerak terus menerus secara sembarangan.
Teori kinetik ini memiliki dugaan yang cocok dengan situasi dan kondisi atom atau molekul penyusun gas. Gaya tarik antara atom‐atom atau molekul‐molekul penyusun gas sangat lemah, karenanya atom atau molekul bisa bergerak bebas.
Ketika bergerak, atom atau molekul mempunyai kecepatan. Atom atau molekul juga mempunyai massa. Atom atau molekul mempunyai energi kinetik (EK) dan momentum (p) dikarenakan mempunyai massa (m) dan kecepatan (v).
Energi kinetik (EK) = 1⁄2 m v2 .
Sedangkan momentum : p = m v. Terdapat gaya (F) selain energi kinetik dan momentum. Ketika bergerak bebas, pasti terjadi tumbukan. Ini berarti gaya muncul karena adanya perubahan momentum ketika terjadi tumbukan.
Energi kinetik, momentum dan gaya impuls merupakan inti pembahasan kita pada materi dinamika (hukum newton, impuls dan momentum). Dengan kata lain teori kinetik gas pada sesungguhnya menerapkan ilmu dinamika pada tingkat atom atau molekul penyusun zat gas.
Teori kinetik gas adalah gas yang terbentuk dari molekul-molekul gas yang bergerak secara acak dengan arah gerak konstan. Molekul gas bergerak dengan kecepatan tinggi dan saling bertabrakan dengan molekul lainnya dan juga dengan dinding secara terus-menerus.
Baca Juga :
1. Rumus Gerak Lurus Berubah Beraturan
2. Rumus Gaya Gesek: Pengertian dan Macam-Macam Gaya Gesek
3. Pengertian Hukum Kekekalan Energi
Asumsi Pada Teori Kinetik Gas
Berikut asumsi-asumsi yang mendukung properti gas berdasarkan teori kinetik
- Terbentuknya gas dari molekul-molekul gas yang bergerak secara konstan dan acak. Molekul bergerak secara lurus hingga bertabrakan dengan molekul lainnya atau dengan dinding.
- Molekul dianggap titik bermassa yang tidak memiliki volume.
- Tidak terdapat gaya molekular yang bekerja. (tidak ada gaya tarik-menarik atau tolak-menolak antar molekul)
- Tekanan gas disebabkan karena tabrakan molekul-molekul gas. Tidak ada energi yang hilang atau terbentuk karena tabrakan.
- Waktu terjadinya tabrakan diabaikan dibandingkan dengan waktu antara tabrakan.
- Energi kinetik gas merupakan sebuah pengukuran yang berdasarkan temperatur gas dalam Kelvin.
- Energi kinetik rata-rata molekul gas sebanding dengan temperaturnya. Peningkatan temperatur berbanding lurus dengan kecepatan gerak molekul.
- Semua gas pada temperatur yang ditentukan memiliki energi kinetik rata-rata yang sama.
- Molekul gas yang lebih ringan bergerak lebih cepat dibandingkan molekul gas yang lebih berat.
Hukum Standar ABC Gas
Hukum Avogrado
\frac{V}{n} = k
Demikian dari kami tentang teori kinetik gas. Jika masih ada yang belum jelas, silahkan bertanya di kolom komentar.